盤點|小癌種?無藥物?這三款不限癌種抗癌藥,你值得了解~2019-08-21 08:47
 相信部分讀者一定有這樣的疑問,目前國家藥品監督管理局(NMPA)以及美國食品與藥品監督管理局(FDA)批準上市的大部分抗癌藥物,均匹配有一定的適應癥且目前隨著臨床研究的進行各種藥物一直在努力擴展適應癥,但目前這些適應癥普遍集中于肺癌、結直腸癌、黑色素瘤、霍奇金淋巴癥等發病率較高的癌種。一些發病率低/研究不那么清晰的癌種,幾乎無相應的抗癌藥物可用,怎么辦? 那么對于這類型的癌癥患者,小編今天就為其盤點一下目前美國食品與藥品監督管理局FDA批準上市的三款不分癌種的抗癌藥物。 臨床試驗數據 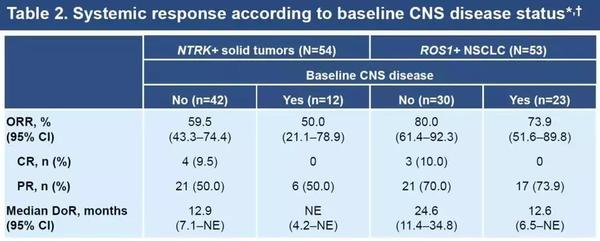 恩曲替尼的具體臨床數據(ALKA-372-001、STARTRK-1和STARTRK-2): 招募54位NTRK1/2/3融合和53位ROS1肺癌的患者,涵蓋了肉瘤、非小細胞肺癌、乳腺癌和腸癌等患者。其中,NTRK融合的患者,22%具有腦轉移;ROS1融合的患者,43%具有腦轉移。 針對NTRK融合:54位患者中,有31位患者腫瘤明顯縮小,客觀有效率57%,其中42位沒有腦轉移的患者有效率59.5%,12位有腦轉移的患者有效率50%; 針對ROS1融合: 53位肺癌,41位患者腫瘤明顯縮小,客觀有效率77%,其中30位沒有腦轉移的患者有效率80%,23位有腦轉移的患者有效率73.9%。 臨床試驗數據  2018年10月歐洲腫瘤內科學會年會(ESMO)上,Larotrectinib公布一組臨床數據,122例NTRK融合患者的綜合數據集(109例納入療效分析)包括24種不同腫瘤類型的TRK融合癌的成人和兒童患者,年齡從大約1個月到80歲不等。 Larotrectinib總體有效率保持在81%,其中17%的患者腫瘤完全消失。
正是基于以上臨床數據,K藥獲得美國食品與藥品監督管理局(FDA)加速批準用于MSI-H陽性的實體瘤治療。 K藥被美國食品與藥品監督管理局(FDA)批準上市,但是一定要注意的是,任何癌種的患者在使用該藥物之前,推薦進行免疫治療標志物的相關檢測:MSI微衛星不穩定性檢測(若為MSI-H,推薦使用K藥),TMB腫瘤突變負荷檢測,PD-L1表達檢測,根據相應的檢測結果,根據醫生的推薦使用K藥。 雖然目前這三款藥物均被美國食品與藥品監督管理局(FDA)批準相應不限癌種的適應癥。但現狀是,除了K藥,其他兩款藥物并未在國內上市,而且K藥在國內獲批的適應癥也并未非有高度微衛星不穩定性(MSI-H)或錯配修復基因缺陷(dMMR)的不可切除的或轉移性實體腫瘤患者。不過相信,隨著近期國家藥品監督管理局NMPA的幾項給力審批,相信這些廣譜抗癌藥物也能夠盡快在國內上市,造福更多患者。 8月19日為中國醫師節,在這特別的節日里向各位醫生道聲“感謝”,說聲“辛苦”。
上一篇: 考勤管理制度
下一篇: 活檢也會出“差錯”?瘤內異質來搗蛋~
|