國內患者福音,K藥聯合化療獲批非小細胞肺癌一線治療!2019-04-03 08:40
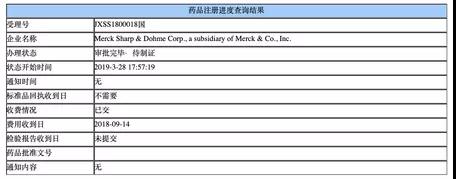 導 語 2019年3月28日,國家藥品監督管理局(NMPA)官網顯示, PD-1抑制劑帕博利珠單抗聯合培美曲塞和鉑類化療藥物一線治療表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性的轉移性非鱗狀非小細胞肺癌(NSCLC)的適應證正式獲批。
小編看到該消息內心十分激動,2019年我國藥監局出臺了允許使用境外臨床數據的新規,得益于該條新規,K藥被納入了加速審評審批的名單。而今,K藥聯合化療獲批非小細胞一線治療,此次獲批只比美國晚7個月,小編真想為我國藥監局建立個夸夸群,好好夸一夸這給力的審批~ K藥(帕博利珠單抗,商品名:可瑞達、Keytruda)相信大家并不陌生,作為PD-1抑制劑藥物,一直是被廣大患者認為“神藥“的存在。 在美國,K藥至今已被FDA獲批16個適應癥,涵蓋黑色素瘤、頭頸癌、非小細胞肺癌、經典霍奇金淋巴瘤、胃癌、肝癌、子宮頸癌、默克爾細胞癌、尿路上皮癌、原發縱隔大B細胞淋巴瘤等多個癌種。
在國內,2018年7月25日,K藥被閃電獲批,用于經一線治療失敗的不可切除或轉移性黑色素瘤的治療,成為了我國首個用于治療晚期黑色素瘤的PD-1抑制劑藥物。而此次再次獲批用于非鱗狀非小細肺癌,成為首款在中國大陸獲批兩個適應癥的PD-1抑制劑藥物。
帕博利珠單抗 肺癌作為我國發病率和死亡率都占首位的癌種,雖然K藥在國內只審批通過非鱗狀非小細胞肺癌的一線治療,但K藥已經被FDA批準適用于非小細胞肺癌患者的各種適應癥,且獲批適應癥的相關臨床試驗數據也較為給力,今天小編就來給大家詳細介紹一下~ 2018年10月 2017年05月 2016年10月 K藥被FDA批準單獨用于轉移性非小細胞肺癌患者(PD-L1表達≥50%,且EGFR和ALK突變陰性)的一線治療。 2015年10月 K藥被FDA批準單獨用于采用含鉑類化療不起作用或疾病進展且PD-L1表達≥1%的晚期非小細胞肺癌,或者EGFR和ALK突變陽性且用過相關抑制劑不起作用或疾病進展的晚期非小細胞肺癌。
K藥聯合培美曲塞和鉑類化療藥物一線治療非鱗狀非小細胞肺癌能被CFDA及FDA先后批準,是基于Keynote-189的臨床試驗(試驗數據見下圖)。 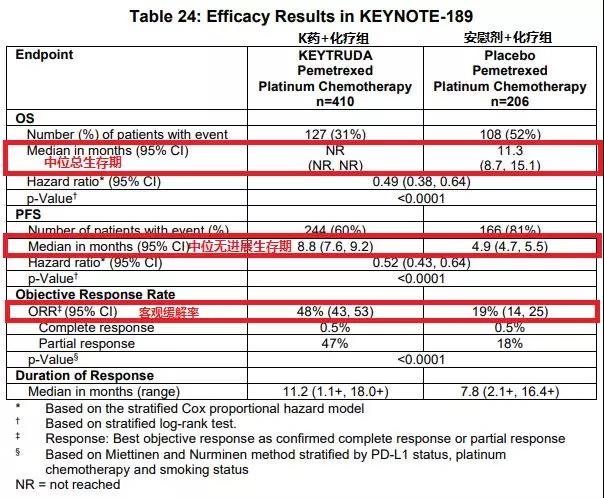 KEYNOTE-189為一項隨機、對照、雙盲設計的III期臨床試驗,入組616名初治的晚期非鱗NSCLC患者,無EGFR突變或ALK融合基因。患者按2:1隨機入組到培美曲塞/鉑類聯合帕博利珠單抗組(200mg,每3周給藥1次,連續4個周期),或培美曲塞/鉑類聯合安慰劑組。
K藥被FDA批準聯合標準化療(卡鉑、紫杉醇/白蛋白紫杉醇)用于鱗狀非小細胞肺癌的一線治療是基于KEYNOTE-407的臨床試驗(試驗數據見下圖)。 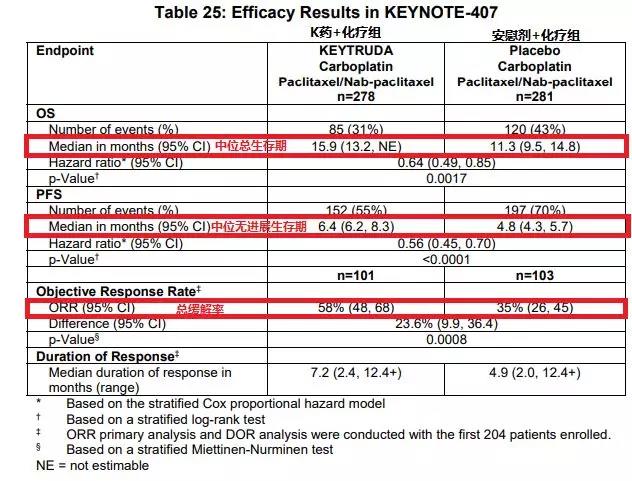 KEYNOTE-407是一項隨機、對照、雙盲設計的III期臨床試驗,入組559名初治的晚期鱗狀NSCLC患者。患者按1:1隨機入組到卡鉑、紫杉醇/白蛋白紫杉醇聯合帕博利珠單抗組(200mg,每3周給藥1次,連續4個周期),或卡鉑、紫杉醇/白蛋白紫杉醇聯合安慰劑組。
K藥被FDA批準單獨用于轉移性非小細胞肺癌患者(PD-L1表達≥50%,且EGFR和ALK突變陰性)的一線治療,是基于KEYNOTE-024的臨床試驗(試驗數據見下圖)。
KEYNOTE-024一項隨機、對照、雙盲設計的III期臨床試驗,在305名轉移性NSCLC患者中進行,患者要求在此之前沒有系統性化療治療晚期癌癥,EGFR突變或ALK融合陰性,并且由FDA批準的測試測定腫瘤表達高水平的PD- L1(TPS大于等于50%或更多)的患者。患者按1:1隨機入組到帕博利珠單抗組(200mg,每3周給藥1次),或標準療法含鉑化療對照組。
K藥被FDA批準單獨用于采用含鉑類化療不起作用或疾病進展且PD-L1表達≥1%的晚期非小細胞肺癌,或者EGFR和ALK突變陽性且用過相關抑制劑不起作用或疾病進展的晚期非小細胞肺癌,是基于KEYNOTE-010的臨床試驗(試驗數據見下圖)。
KEYNOTE-010是一項隨機、對照、雙盲設計的II/III期臨床研究,納入1034例腫瘤PD-L1表達呈陽性且既往接受過至少一種化療方案的局部晚期或轉移性非小細胞肺癌患者,其中EGFR或ALK陽性的患者,已接受過相應的靶向藥治療。患者按1:1:1隨機入組到分別給予標準劑量2mg/kg Keytruda組,高劑量10mg/kg Keytruda組或75mg/m2多西他賽,所有方案均為每3周一次。 看到小編梳理關于K藥在非小細胞肺癌領域各種給力的臨床試驗數據,相信各位內心一定十分高興。 小編有注意此次國內批準并沒有限定PD-L1表達值,也就是說無論PD-L1表達量高還是低,對于符合條件的非鱗癌非小細胞患者均可采用K藥加化療藥物聯合使用的方式進行治療。 據小編了解,2018年10月16日,國家食品藥品監督管理總局藥品評審中心(CDE)也已經正式受理“K藥”+標準化療作為一線藥物治療鱗狀NSCLC的申請,相信離審批通過也不遠了~ 截至目前,除了K藥之外,還有另外3款免疫檢查點抑制劑在國內獲批,且均為PD-1抑制劑。且在K藥獲批非小細胞肺癌適應癥之前,O藥(納武利尤單抗)已成功在國內獲批非小細胞肺癌適應癥。
湖南時代基因擁有一支以分子生物學、藥物基因組學、臨床醫學、計算機科學為主的復合型專業技術團隊,致力于腫瘤、心血管疾病等重大疾病的精準診斷和臨床個性化治療醫學檢驗服務、腫瘤液體活檢技術的臨床應用與科研服務、轉化醫學服務。 若各位小伙伴對癌癥基因檢測或相關藥物信息感興趣的話,歡迎致電400-700-2166,小編24小時為大家提供咨詢服務
國家藥品監督管理局藥品審評中心. https://www.keytruda.com/how-does-keytruda-work/ https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/125514s040lbl.pdf Gandhi L, Rodgríguez-Abreu D, Gadgeel S, et al. pembrolizumab plus chemotherapy in metastatic non–small-cell lung cancer [published online April 16, 2018]. N Engl J Med. doi: 10.1056/NEJMoa1801005. Paz-Ares LG, Luft A, Tafreshi A, et al. Phase 3 study of carboplatin-paclitaxel/nab-paclitaxel (Chemo) with or without pembrolizumab (Pembro) for patients (Pts) with metastatic squamous (Sq) non-small cell lung cancer (NSCLC). J Clin Oncol. 2018;36 (suppl; abstr 105).
|